初中化学
化学名词解释
| 名词 |
解释 |
| 物理变化 |
物质没有生成其他物质的变化 |
| 化学变化 |
物质生成了其他物质的变化 |
| 物理性质 |
不需化学反应表现的性质 |
| 化学性质 |
需要化学反应表现的性质 |
|
|
| 混合物 |
多种物质混合组成,例如空气 |
| 纯净物 |
单种物质,例如:O2,H2O |
| 单质 |
仅含有单种元素的纯净物 |
| 化合物 |
含有不同元素的纯净物 |
| 氧化物 |
两种元素组成的化合物中有一种元素是氧 |
| 原子 |
化学变化中的最小粒子 |
| 元素 |
质子相同的一类原子 |
| 分子 |
维持化学性质的最小粒子 |
| 阳离子 |
失去电子的原子 |
| 阴离子 |
从外界得到电子的原子 |
| 电子 |
又叫核外电子,每一个带一个负电荷,质量忽略不计 |
| 质子 |
每个质子带一个正电荷,质量占一个相对原子质量 |
| 中子 |
中子不带电荷,质量占一个相对原子质量 |
|
|
| 化合反应 |
多种物质生成一种物质 |
| 分解反应 |
一种物质分解多种物质 |
| 置换反应 |
单质与化合物反应生成另外的单质和化合物 |
|
|
| 相对原子质量 |
指以一个标准碳原子质量的1/12作为标准,其他原子和这个标准的比值 |
| 相对分子质量 |
同理是一个分子质量和标准的比值 |
|
|
| 化学式 |
使用H2O,O2等符号表示物质的方式 |
| 化学方程式 |
使用符号表示物质反应的式子 |
| 化合价 |
形成化合物时元素的个数比 |
|
|
| 可燃物 |
可以被燃烧的物质,如木材、塑料等 |
| 助燃物 |
参与燃烧的氧化剂,主要是空气中的氧气。 |
| 着火点 |
引发燃烧的能量,明火,电火花等 |
实验仪器及注意事项
仪器
烧杯
作用
- 物质的反应器、确定燃烧产物。
- 溶解、结晶某物质。
- 盛取、蒸发浓缩或加热溶液。
- 盛放腐蚀性固体药品进行称重。
试管

作用
- 作少量试剂的反应容器。
- 收集少量气体。
- 装配小型气体发生器。
玻璃棒
作用
-
在过滤等情况下转移液体的导流;
-
用于溶解、蒸发等情况下的搅拌;
-
对液体和固体的转移;
-
引发反应 ,如引燃红磷;
-
使热量均匀散开。
酒精灯
作用
- 作为热源。
- 进行焰色反应。
- 微生物实验室用来灭菌等。
- 玻璃仪器加工。
- 其它工艺品制作
石棉网

作用
- 使物体受热均匀
- 主要用于加热液体时架在酒精灯的三脚架上
量筒

作用
量杯
作用
- 它用于量度从量器中排出液体的体积。
- 排出液体的体积为该液体在量器内时从刻度值读取的体积数。
蒸发皿
作用
坩埚
作用
坩埚钳
漏斗
作用
分液漏斗
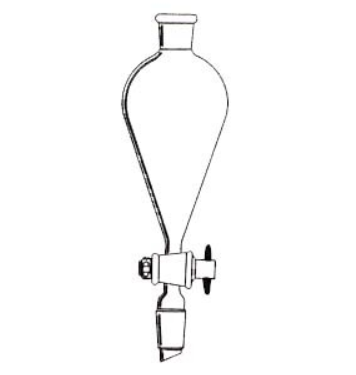
作用
- 固液或液体与液体反应发生装置,控制所加液体的量及反应速率的大小.
- 物质分离提纯,对萃取后形成的互不相溶的两液体进行分液。
注意事项
物质性质
二氧化硫:刺激性气味
一氧化碳:无色无味,有毒
氯化氢气体:有窒息气味,对上呼吸道有刺激,和水生产盐酸
物质颜色
| 颜色 |
物质 |
| 蓝色固体 |
氢氧化铜,五水硫酸铜晶体 |
| 蓝色液体 |
硫酸铜溶液,氯化铜溶液,硝酸铜溶液 |
|
|
| 红色固体 |
铜(紫红色),氧化铁 |
| 红棕色气体 |
二氧化氮 |
|
|
| 绿色固体 |
碱式碳酸铜 |
| 浅绿色液体 |
硫酸亚铁,氯化亚铁,硝酸亚铁 |
| 黄绿色气体 |
氯气 |
|
|
| 紫黑色固体 |
高猛酸钾 |
| 紫红色溶液 |
高猛酸钾溶液 |
| 紫色溶液 |
石蕊溶液 |
| 黑色固体 |
铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,氧化亚铁 |
| 淡黄色固体 |
硫磺 |
| 黄色液体 |
硫酸铁溶液,氯化铁溶液,硝酸铁溶液 |
| 红褐色固体 |
氢氧化铁 |
| 银白色固体 |
铁,银,镁,铝, |
| 银白色液体 |
汞 |
| 白色固体 |
氧化钙,氯化钠,氢氧化钠,氢氧化钙,碳酸钙,五氧化二磷,氧化镁,无水硫酸铜 |
| 无色固体 |
干冰,冰,金刚石 |
| 无色液体 |
双氧水,水 |
| 无色气体 |
氧气,氮气,氢气,二氧化碳,一氧化碳,氯化氢气体,二氧化硫 |
金属
金属性质:导电,导热,有光泽,有延展性,能弯曲
| 合金 |
组成 |
| 生铁 |
碳铁合金,碳含量在2%以上 |
| 不锈钢 |
铁铬镍合金 |
| 黄铜 |
铜锌合金 |
| 青铜 |
铜锡合金 |
金属活动性顺序,从左到右活动性变弱
钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金
- 大多数金属都能被氧化,这个反应是氧化反应
- 氢之前的可以和盐酸,稀硫酸反应。置换出氢
- 活动性强的可以置换活动性弱的金属
铝(Al)
4Al+3O22Al2O3
铝和氧气生成氧化铝,氧化铝又叫刚玉高硬度化合物,致密氧化膜封闭不透气可以阻止里面的铝进一步被氧化
铝土矿:氧化铝
铁(Fe)
3Fe+2O2点燃Fe3O44Fe+3O22Fe2O3Fe+O2高温FeO
Fe2O3+3CO高温2Fe+3CO2FeO+CO高温Fe+CO2
Fe2O3+3H2加热2Fe+3H2OFeO+2H2加热Fe+H2O
铁生锈的条件
2Fe+O2+2H2O2Fe(OH)24Fe(OH)2+O2+2H2O4Fe(OH)32Fe(OH)3Fe2O3+3H2O总:4Fe+3O2+XH2O2Fe2O3⋅XH2O
- 氢氧化铁:为棕色或红褐色粉末或深棕色絮状沉淀或胶体,固体时则为铁红色沉淀
- 氢氧化亚铁:为白色固体,且难溶于水
铁矿物
- 赤铁矿:氧化铁
- 磁铁矿:四氧化三铁
- 菱铁矿:碳酸亚铁(FeCO3)
Fe+HClFeCl3+H2↑2FeCl3+Fe3FeCl2Fe+H2SO4FeSO4+H2↑
铁遇冷的浓硫酸或浓硝酸会钝化生成致密的氧化膜(主要成分Fe₃O₄)故可用铁器装运浓硫酸和浓硝酸
标志反应产物是Fe₃O₄
3Fe+H2SO4(浓)Fe3O4+4SO2↑+4H2O3Fe+8HNO3(浓)Fe3O4+8NO2↑+4H2O
铁遇到热点浓硫酸或浓硝酸会反应
标志反应产物分别硫酸铁,硝酸铁
2Fe+6H2SO4(浓)ΔFe2(SO4)3+3SO2+6H2O2Fe+6HNO3(浓)ΔFe2(NO3)3+3NO2↑+3H2O
铜(Cu)
Cu+H2SO4CuSO4+H2↑
波尔多液
组成:硫酸铜和生石灰加水配置。
溶液注意事项:
- 不能使用铁桶盛放,因为铁会置换出硫酸铜里的铜
- 不能和碳酸钠混用,因为生石灰配置的波尔多液生成的是氢氧化钙会反应生成碳酸钙沉淀
镁(Mg)
2Mg+2HCl2MgCl+H2↑Mg+H2SO4MgSO4+H2↑Mg+2H₂SO₄(浓)加热MgSO₄+SO₂↑+2H₂OMg+H2SO3MgSO3+H2↑
锌(Zn)
2Zn+2HCl2ZnCl+H2↑Zn+H2SO4ZnSO4+H2↑Zn+2H₂SO₄(浓)加热ZnSO₄+SO₂↑+2H₂OZn+H2SO3ZnSO3+H2↑
溶液
溶液是由溶剂和溶质(气体液体固体)组成。溶质在溶液中以离子形式存在
碘几乎不溶于水,但可以溶在汽油中
高锰酸钾几乎不溶于汽油,但可以溶在水中
乳浊液:不集合成小液滴,不溶于水
硫酸钡乳浊液在检查肠胃病的时候使用,作为X射线的造影剂
碳酸氢钠治疗胃酸过多,但是会产生气体,胃穿孔的病人禁止使用
氢氧化铝治疗胃酸过多,通用
溶液饱和度
溶剂溶解溶质都有量的限制,而且随温度变化也有变化,通常温度升高溶剂量增加。
每一百克水最多能溶的溶质质量叫溶解度
| 溶质 |
温度升高 |
| 氯化钠 |
影响不大 |
| 氢氧化钙 |
溶解度降低 |
| 硝酸钾 |
溶解度急速升高 |
气体溶解度
101kPa大气压一体积水能溶的气体的体积例如:一体积水溶一体积二氧化碳
硝酸钾混有氯化钠,重结晶法,将混合物放入水中升温并配置成饱和溶液,降温结晶出硝酸钾过滤
原理:氯化钠溶解度随温度变化不大氯化钠晶体仍在溶液中,升温变成饱和溶液冷却结晶的时候析出的都是硝酸钾晶体。
氯化钠混有硝酸钾,混合物全部溶解,蒸发浓缩,析出氯化钠趁热过滤
原理:两者全部溶剂,蒸发浓缩后析出的是氯化钠,以为硝酸钾溶解度大仍在溶液,趁热硝酸钾未析出过滤出氯化钠。
溶质的质量分数=溶液质量溶质质量×100%
酸碱盐
酸碱指示剂
无色酚酞:酸无碱红
酸碱性质
- 酸+活泼金属=盐+氢气(活泼的金属一般指金属活动性顺序在氢之前的元素)
- 酸+金属氧化物=盐+水(碱性氧化物以及两性氧化物反应生成盐和水)
- 碱+非金属氧化物=盐+水(CO除外)
- 酸+碱=盐+水(酸碱中和反应都放热)
硫酸
硫酸具有腐蚀性,脱水性,吸水性,氧化性
浓硫酸稀释:将浓硫酸倒入水中,因为稀释放热液体会飞溅
不慎沾上硫酸需要水洗涂上碳酸氢钠
硫酸和金属
Fe+H2SO4FeSO4+H2↑Cu+H2SO4CuSO4+H2↑Mg+H2SO4MgSO4+H2↑Zn+H2SO4ZnSO4+H2↑
硫酸和氢氧化物
3H2SO4+2Fe(OH)3Fe2(SO4)3+6H2OH2SO4+Fe(OH)2FeSO4+2H2OH2SO4+Cu(OH)2CuSO4+2H2OH2SO4+NaOHNa2SO4+H2OH2SO4+KOHK2SO4+H2O
硫酸和金属氧化物
3H2SO4+Fe2O32Fe2(SO4)3+3H2OH2SO4+FeOFeSO4+H2OH2SO4+CuOCuSO4+H2O
硫酸和盐生成沉淀
盐酸
Fe2O3+6HCl2FeCl3+3H2O
氢氧化钠
又名苛性碱,火碱
性质:容易吸收水分,可以和油脂反应
如果不慎沾上氢氧化钠需要用水洗然后涂上硼酸
2NaOH+CO2Na2CO3+H2O2NaOH+SO2Na2SO3+H2O2NaOH+SO3Na2SO4+H2ONaOH+SO3Na2HSO4
氢氧化钙
俗称熟石灰或消石灰
性质:微溶于水
CaO+H2OCa(OH)2Ca(OH)2+NaCO32NaOH+CaCO3↓Ca(OH)2+CO2CaCO3↓+H2OCa(OH)2+SO2CaSO3↓+H2O
酸碱中和
酸碱中和大部分会生成盐和水
NaOH+HClNaCl+H2O2NaOH+H2SO4Na2SO4+2H2O2NaOH+H2SO3Na2SO3+2H2O
Ca(OH)2+2HClCaCl2+2H2OCa(OH)2+H2SO4CaSO4↓+H2OCa(OH)2+H2SO3CaSO3↓+H2O
PH
PH的范围是0~14
酸<7<碱
化学常识
化学俗称
- 氯化钠(NaCI) :食盐
- 碳酸钠(Na2C03) :纯碱,苏打,口碱
- 氢氧化钠(NaOH) :火碱,烧碱,苛性钠
- 氧化钙(Ca0) :生石灰
- 氢氧化钙(Ca(OH)2) :熟石灰,消石灰
- 二氧化碳固体(CO2) :干冰
- 氢氯酸(HCI) :盐酸
- 碱式碳酸铜(Cu2(OH)2CO3) :铜绿
- 硫酸铜晶体(CuSO4.5H2O) :蓝矾,胆矾
- 甲烷(CH4) :沼气
- 乙醇(C2H5OH) :酒精
- 乙酸(CH3COOH) :醋酸
- 过氧化氢(H202) :双氧水
- 汞(Hg) :水银
- 碳酸氢钠(NaHC03) :小苏打
质量增加
- 吸水:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
- 和水反应:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;
- 跟二氧化碳反应:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;
质量减少
- 挥发:浓盐酸,浓硝酸,酒精,汽油,浓氨水;
- 风化:碳酸钠晶体。
气体检验
- 氧气:带火星的木条放入瓶中,若木条复燃,则是氧气
- 氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯。观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.
- 一氧化碳:点燃其他,通入澄清的石灰水,若变浑浊则是一氧化碳
- 二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.
- 氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.
- 水蒸气:通过无水硫酸铜,若白色固体变蓝,则含
离子检验
- 氢离子:滴加紫色石蕊试液/加入锌粒
- 氢氧根离子:酚酞试液/硫酸铜溶液
- 碳酸根离子:稀盐酸和澄清的石灰水
- 氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子
- 硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡
- 铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口
- 铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子
- 铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子
杂质或变质检验
- 如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质
- 检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石
- 检验NaOH中是否含有NaCl :先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCI。
除杂
高中化学
名词概念
物质的量
- 是一个物理量,单位是mol
- 表示粒子的个数
- 1mol=1阿伏伽德罗常数(NA)=6.02×1023
摩尔质量
每1mol粒子的质量,1mol氢原子摩尔质量是1g/mol
n=Mm
气体摩尔体积
- 气体都是使用体积代替质量,标准状况每1mol气体粒子的体积。
- 标准状况:0℃,101kPa
- 标准状况下气体摩尔体积约为22.4L/mol
- 同温同压下相同体积气体所含粒子数相同
Vm=nV
常用关系式
PV=nRTP:压强V:体积n:物质的量R:常数8.314T:温度查理定律 当n,V一定时p,T成正比,即p∝T盖−吕萨克定律 当n,p一定时V,T成正比,即V∝T阿伏伽德罗定律 当T,p一定时V,n成正比,即V∝n
物质的量浓度
- 单位体积溶液中含有B物质的量cB
- 单位是mol/L
cB=VnB
符号概念及关系
n物质的量,m质量,V体积,N粒子数,NA阿伏伽德罗常数,M摩尔质量,Vm气体摩尔体积,c物质的量浓度n=NAN=Mm=VmV=cVm
物质分类
分类方法有交叉分类法,树状分类法。
- 分散系:一种物质分散到另一种物质里
- 分散质:被分散的物质
- 分散剂:容纳分撒质的物质
溶液<1nm<胶体<100nm<浊液
- 溶液:硫酸铜溶液,氯化钠溶液等离子型的溶液
- 胶体:豆浆,淀粉溶液,蛋白质溶液,烟、云、雾,江河之水,Fe(OH)3
- 浊液:泥水
丁达尔效应:胶体常有的性质。用来区分胶体和溶液
电泳:胶体粒子因带有电荷在分散剂力定向移动,氢氧化铁胶体是正粒子
实验
实验仪器
容量瓶
作用:
冷凝管
作用
粗盐提纯
粗盐中一般含有泥沙,可溶的CaCl2,MgCl2,硫酸盐等杂质
溶解=>过滤=>去除可溶杂质=>蒸发
- 去除硫酸盐:加入过量氯化钡
- 去除MgCl2:加入过量氢氧化钠
- 去除CaCl2:加入过量碳酸钠
碳酸钠一定要在氯化钡后面,为了除去过量的氯化钡
四氯化碳萃取碘
碘水:棕黄色
四氯化碳:无色,四氯化碳不溶于水,密度大于水
碘的四氯化碳:紫色
蒸馏碘的四氯化碳剩下纯碘
离子反应
电解质:水溶液里或熔融状态下能够导电的化合物。他们在水中发生的叫电离
NaClNa++Cl−H2SO42H++SO42−
- 电离时生成的阳离子都是H+叫酸
- 电离电离时生成的阳离子都是OH-叫碱
强电解质:在水溶液中,完全电离的电解质,包括强酸、强碱和许多盐类。
NaCl,HCl,H2SO4,NaOH
弱电解质:在水溶液中,部分电离的电解质,包括弱酸、弱碱和部分盐类。
酸:H2S、H2CO3、CH3COOH、HF、HCN(氰化氢)、HClO、H2SO3碱:Al(OH)3,Zn(OH)2,NH3⋅H2O(氨水),Cu(OH)2盐:NaHCO3,HgCl2、Pb(Ac)2、HgBr2、CdI2
强电解质导电能力强于弱电解质
强电解质
强酸,强碱,大部分的盐
强酸完全电离
H2SO42H++SO42−HClH−+Cl−NaOHNa++OH−NaClNa++Cl−
部分盐第二部不完全电离,但是他是强电解质
NaHCO3Na++HCO3−<>Na++H++CO32−
弱电解质
弱酸:H2S,H2CO3,CH3COOH,HF,HCN,HClO,H2SO3弱碱:NH3⋅H2O,Al(OH)3,Zn(OH)2少部分盐
弱电解质分布电离,电离可逆
H2S<>HS−+H+<>S2−+2H+H2CO3<>HCO3−+H+<>CO32−+2H+NH3⋅H2O<>NH4++OH−
离子方程式写法
- 化学方程式
- 除了沉淀,水,气体其他化合物都写成离子
- 去掉两边重复的离子
- 检查配平
除了沉淀,水,气体化合物写成离子
碳酸钙中加入过量盐酸CaCO3+2H+=CO2+Ca2++H2O氯化钙溶液中加入硫酸钠溶液CaSO4是微溶物,像Ag2SO4、MgCO3、Ca(OH)2等微溶物,若作为生成物在书写离子方程式时均不能拆开SO42−+Ca2+=CaSO4d弱电解质不拆氯化铝溶液中加入过量氨水Al3++3NH3⋅H2O=Al(OH)3+3NH4+d
强酸强碱可溶性盐,凡是有钾钠硝铵的拆
弱酸弱碱,气体,沉淀,水,浓硫酸不拆
氧化还原反应
电子得失或电子转移,化合价有变化
在氧化反应的同时又存在还原反应。一个物质被还原另一个物质就会被氧化。
- 还原反应:所含元素化合价降低
- 氧化反应:所含元素化合价升高
- 还原性:还原剂元素的价位可以升高
- 氧化性:氧化剂元素的价位可以降低
氧化剂有>氧化性发生反应>还原反应>被还原生成>还原产物还原剂有>还原性发生反应>氧化反应>被氧化生成>氧化产物
常见的氧化剂:Cl2,H2SO4,HNO3,KMnO4(H+),Fe3+常见的还原剂:Zn,H+,CO,Fe2+,H2S,I−
单线桥,双线桥(书)
氧化还原强弱关系
金属性强还原性强
K−Ca−Na−Mg−Al−Zn−Fe−Sn−Pb−(H)−Cu−Hg−Ag−Pt−Au————————————————————————————————————————————————>金属活动性减弱,还原性减弱K+−Ca2+−Na+−Mg2+−Al3+−Zn2+−Fe2+−Sn−Pb−(H)−Cu−Hg−Ag−Pt−Au——————————————————————————————————————————————————————————>氧化性增强
非金属性强氧化性强
F2−Cl2−Br2−(Fe3+)−I2−S−P——————————————————————>非金属性减弱,氧化性减弱F−−Cl−−Br−−(Fe2+)−I−−S2−−P3−—————————————————————————>还原性增强
歧化反应:一个化合物的化合物价又升又降
2KClO3MnO2Δ2KCl+3O2Cl2+2NaOHNaCl+NaClO+H2O
归中反应:两个化合价合并成一个化合价
2H2S+SO23S↓+2H2O
氧化还原性的强弱
得电子失电子的能力
判断反应是否发生的方法
- 氧化剂的氧化性>氧化产物的氧化性
- 还原剂的还原性>还原产物的还原性
- 根据金属活动顺序,对应的离子。(Fe对应的是二价铁)
- 非金属元素活动顺序
金属
钠(Na)
- 化学性质:活泼,在空气中能发生反应。必须保存在石蜡或煤油中
- 物理性质:银白色,固体
和钠有关的物质
| 名称 |
|
| Na2O |
Na直接和氧气反应生成,白色固体 |
| Na2O2 |
Na加热和氧气反应生成,淡黄色固体 |
| NaOH |
Na溶于水生成,酚酞溶液变红,固体状态下是白色半透明,结晶状 |
| Na2CO3 |
NaOH变质生成,固体状态下是白色 |
| NaHCO3 |
NaOH不充分变质生成,固体状态下是白色 |
| NaAlO2 |
白色颗粒。易吸湿。极易溶于水,不溶于乙醇 |
4Na+O22Na2ONa2O+H2O2NaOHNa2O+CO2Na2CO3
2Na+O2ΔNa2O22Na2O2+2H2O4NaOH+O2↑2Na2O2+2CO22Na2CO3+O2
足量氢氧化钠:2NaOH+CO2Na2CO3+H2O不足氢氧化钠:NaOH+CO2NaHCO3
钠放入水中
- 现象:钠浮在水面上,发出嘶嘶的响声,并四处游动,熔成小球
2Na+2H2O2NaOH+H2↑
铝(Al)
既能和盐酸反应又能和氢氧化钠反应。
Al+HClAlCl+H2↑2Al+2NaOH+2H2O2NaAlO2+3H2↑
氧化铝:刚玉,熔点高硬度大。难溶于水可以溶于酸或强碱。两性氧化物
Al2O3+6HCl2AlCl3+3H2OAl2O3+2NaOH2NaAlO2+H2O
氢氧化铝:胶体不溶于水,溶于酸或强碱.两性氢氧化物
Al2(SO4)3+6NH3⋅H2O2Al(OH)3+3(NH4)2SO4Al(OH)3+3HClAlCl+3H2OAl(OH)3+NaOHNaAlO2+2H2O
2Al(OH)3ΔAl2O3+3H2O
铁(Fe)
铁的氧化物是碱性氧化物可以和酸反应
FeO+2H+Fe2++H2OFe2O3+6H+2Fe3++3H2O
铁的氢氧化物
Fe2++OH−Fe(OH)2↓4Fe(OH)2+O2+2H2O4Fe(OH)3↓
氢氧化亚铁是白色絮状沉淀,迅速被氧化变成灰绿色(因为中间经过了亚铁离子)最后变成红褐色沉淀(氢氧化铁)
Fe(OH)3ΔFe2O3+3H2O
检验铁离子
检验铁离子一般使用硫氰化钾(KSCN)
| 物质 |
现象 |
| Fe2+ |
颜色无变化 |
| Fe3+ |
棕黄色变成血红色 |
Fe3++3SCN−Fe(SCN)3
上面的反应是络合反应,络合物也难电离的,不能共存,不是沉淀
2FeCl2+Cl22FeCl32FeCl3+Fe3FeCl2
检验亚铁离子使用高锰酸钾
亚铁离子会被高锰酸钾氧化成铁离子,颜色绿色变黄色
MnO4−+5Fe2++8H+Mn2++5Fe3++4H2O
非金属
硅(Si)
硅是一种亲氧元素,都是以氧化物或硅酸盐形式存在
- 二氧化硅:水晶,玛瑙,玻璃、石英的主要成分
- 硅酸:H2>SiO3酸性比碳酸还弱,硅酸溶胶经常被用作干燥剂。酸酐是氧化硅,
- 盐Na2SiO3>:水玻璃(水溶液俗称)经常被用作防火材料
SiO2+4HFSiF4↑+2H2OSiO2+2C高温Si+CO↑ C过量(SiO2+3C高温SiC+CO)SiO2+CaO高温CaSiO3SiO2+2NaOHNa2SiO3+H2O
SiO2+CaCO3高温CaSiO3+CO2↑SiO2+Na2CO3高温Na2SiO3+CO2↑
- 陶瓷:粘土(硅酸盐)
- 水泥:粘土,石灰石
- 玻璃:纯碱,石灰石,氧化硅
氯(Cl)
氯气有毒,颜色是黄绿色,有强烈的刺激性气味。
制氯气
MnO2+4HClΔCl2↑+MnCl2+2H2O2NaCl+2H2O电解Cl2+H2+2NaOH
氯气作为助燃物
H2+Cl2点燃2HCl(苍白色的烟)P+3Cl2点燃2PCl3(白雾,因为他是液体)P+5Cl2点燃2PCl5(白烟)2Na+Cl2点燃2NaCl(黄色火焰,白色烟)2Fe+3Cl2点燃2FeCl3(棕红色的烟,溶于水后表现铁离子颜色性质)Cu+Cl2点燃CuCl2(棕黄色烟,溶于水后表现铜离子颜色性质)
氯气溶于水
氯气溶于水可以消毒漂白,主要起作用的是次氯酸
Cl2+H2HCl+HClO2HClO光照2HCl+O2↑
由于次氯酸容易分解所以制作成不易分解的
Cl2+NaOHNaCl+NaClO(漂白粉)+H2O2Cl2+2Ca(OH)2Ca(ClO)2(漂粉精)+CaCl2+H2OCa(ClO)2+CO2+H2OCaCO3↓+HClO
-
次氯酸HClO
-
亚氯酸HClO2
-
氯酸HClO3
-
高氯酸 HClO4
他的化合价有-1,1,3,5,7
硫(S)
黄色晶体,不溶于水,易溶于酒精,易溶于二硫化碳
S+O2点燃SO2
二氧化硫
二氧化硫无色,有刺激气味有毒,密度大于空气,溶于水
SO2+H2O<>H2SO32SO2+O2<Δ催化剂>SO3SO2+2NaOHNa2SO3+H2OSO2+CuOCuSO3SO2+2H2S2S↓+2H2O
三氧化硫
通常是液体,标准状况下是固体
SO3+H2OH2SO4SO3+CaOCaSO4SO3+2NaOHNa2SO4+H2O
硫酸盐
SO3+CaOCaSO4SO3+Ca(OH)2CaSO4+H2O
H_2S\xlongequal[]{足量O_2}>SO_2\xlongequal[]{O_2}>SO_3\xlongequal[]{H_2O}>H_2SO_4\\
S\xlongequal[]{O_2}>SO_2\xlongequal[]{O_2}>SO_3\xlongequal[]{H_2O}>H_2SO_4\\
\underbrace{SO_2\xlongequal[]{H_2O}>H_2SO_3\xlongequal[]{NaOH}>Na_2SO_3}\xlongequal[]{SO_2}NaHSO_3\\
H_2SO_4 \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \
氮(N)
空气中含量最多的气体。有很多种氧化物
N2O,NO,N2O3,NO2,N2O4,N2O5
价位有1,2,3,4,5
|
NO |
NO2 |
| 颜色 |
无色 |
红棕色 |
| 毒性 |
有毒 |
有毒 |
| 溶解性 |
不溶 |
能溶 |
氮气
N2+3MgMg3N2N2+3H2高压放电2NH3N2+O2高压放电2NO
一氧化氮
NO+O22NO2
二氧化氮
3NO2+H2O2HNO3+NO4NO2+2H2O+O24HNO3NO2+NaOHNaNO3+NaNO2+H2ONO2+NO+2NaOH2NaNO2+H2O
硝酸
3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2OCu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2OC+4HNO3(浓)ΔCO2↑+4NO2↑+2H2O















